免费咨询热线:
400-828-3258

 服务热线
服务热线 联系电话
联系电话 公司地址
公司地址江苏省南京市栖霞区和燕路371号 东南大学国家大学科技园科创楼A301
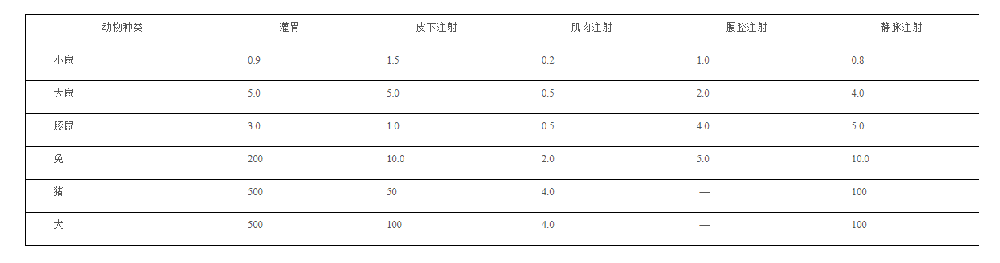
常见的动物给药方法
口服给药
就是灌胃法。在短期实验中,常采用灌胃法。本方法用量准确。灌胃法是用灌胃器将应给动物服用的药物灌入动物的食道或胃的末端。灌胃器由注射器和专用灌胃针组成。小鼠灌胃针长约4-5cm,直径约1mm,大鼠灌胃针长约6-8cm,直径约1.2mm。灌胃针的尖端焊接有一个小的球形突起,它是空心的。目的是防止针头在给药过程中刺破气管或损伤消化道。有两种类型的灌胃针:直的和弯的。弯曲的灌胃针有10度左右的角度,以适应口腔和食道的生理曲度。实验者可以根据个人的熟练程度选择一种。更好的选择是使用塑料灌胃针,可以更好地减少对动物的伤害和刺激。
大鼠灌胃法:左手固定大鼠,右手握住灌胃器,左手拇指和中指固定大鼠前肢,向后用力使大鼠前肢向上抬起。弯曲食指的第一个指节,将关节压在动物的寰椎上,抬起大鼠的头部,使口腔和食道在一条直线上。将灌胃针沿咽后壁缓慢插入食道,使前端达到隔膜水平。药物可以注射。一般情况下,小鼠胃内针的插入深度为3-4厘米,大鼠或豚鼠为4-6厘米。常用的灌胃体积为小鼠0.2-1ml,大鼠1-4ml,豚鼠1-5ml。
大动物灌胃法:固定好动物后,用灌胃软管穿过动物口咽部,进入食管,最后到达贲门。判断进入胃内后,将药液通过软管直接灌入动物胃内。
腹腔注射给药
用腹部向上和头部向下调动动物。右手握住注射器,在两膝之间画一条水平线,在中间右侧进针。如果是母鼠,进步部分与最后一对乳头在同一直线上,进针角度为30度,进针深度为5mm,退出并确保针尖没有刺穿腹腔内容物,然后缓慢注入药物。一次注射量为0.1-0.2ml/10g体重。需要注意的是进针不能向上,以免针头刺伤内脏。如需经常给药,也可在左侧小腹注射。将首先将动物固定,然后将针头插入腹部左侧或右侧的皮下区,沿皮下区向前推约0.5厘米,然后将针头穿过腹肌进入腹腔与皮肤呈 45 度角。抽出肠液和尿液后,缓缓推入药液。
静脉给药
小鼠和大鼠的静脉内给药通常通过尾静脉进行。大鼠有 3 条尾静脉,每侧 1 条,背面 1 条。两侧的尾脉比较容易固定,所以经常使用。操作时,先将动物固定在露出尾巴的固定器中(可用烧杯、铁丝套或粗试管等代替),脱毛后,将尾巴放入45-45℃的温水中50度数分钟或用75%酒精棉球反复擦拭,可扩张血管,软化表皮角质。用左手拇指和食指握住尾巴的两侧以填充静脉。注射时,进针时尽量与尾部成一定角度平行。建议在注射开始时少量缓慢注射。如果没有阻力,说明针已经进入静脉。如果出现白色的皮丘,说明血管还没有被刺破。应将针头移至尾巴根部,再次刺破。注射后将尾巴弯向注射侧或用干棉球等止血物品止血。如果需要重复注射,尽量从尾端开始。
兔子主要使用耳静脉。固定动物后(一般使用兔固定架),用酒精棉球擦拭兔耳缘静脉注射部位并消毒。静脉肿胀后,用注射器注射药物。给药后,通过压迫止血。
犬和猪多采用前肢静脉给药。保定后,用酒精棉球擦拭注射部位消毒,用橡皮筋压迫静脉近端,防止血液回流使静脉肿胀,操作者找到静脉注射部位,用注射器给药药物,给药后松开橡皮筋,按压止血。
常用实验动物最大剂量(ml)